|
NOVIDADES
As enzimas de fosforilação, das quais faz parte a proteína quinase CK2, têm uma papel relevante no controle da proliferação celular. Por conseguinte, o seu mau funcionamento implica num número muito grande de tipos de câncer. Dentro desta perspectiva, os últimos anos têm sido marcados por um aumento crescente das pesquisas que visam inibir a atividade destas enzimas. Atualmente, os inibidores conhecidos da CK2 são compostos orgânicos capazes de neutralizar a atividade da enzima, fixando-se sobre seu sítio catalítico que, lembremo-nos, é a região específica onde se ligam os substratos ou se produz a reação enzimática. Nesse contexto, os trabalhos dos pesquisadores do Institut de Chimie Moléculaire (Instituto de Química Molecular) e Institut de Recherche en Technologies et Sciences pour le Vivant (Instituto de Pesquisa em Tecnologias e Ciências para o Vivente), cujos resultados acabam de ser publicados na revista Chemistry and Biology, são ainda mais importantes. No quadro dessa colaboração entre químicos e biólogos, conseguiram efetivamente evidenciar uma nova classe de inibidores da CK2, os polioxometalatos (POM). Edifícios inorgânicos aniônicos possuem propriedades catalíticas interessantes, eles são compostos principalmente de metais (molibdênio e tungstênio) e de oxigênio. Precisemos que, até hoje, esses são os mais potentes inibidores da CK2, agindo em concentrações nanomolares, ou melhor: extremamente pequenas. Aliás, esses pesquisadores mostraram que o modo de ação desses POM, ainda não elucidado, é totalmente inédito. De fato, contrariamente aos inibidores orgânicos, os POM não se fixam sobre o sítio catalítico da enzima. 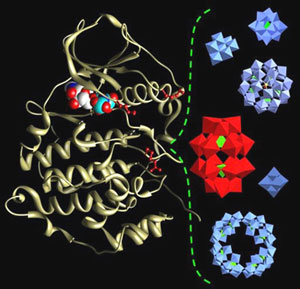 Estrutura da proteína quinase CK2 (à esquerda) e estrutura de diferentes moléculas de polioxometalatos (POM), à direita. Créditos: B. Hasenknopf
CNRS (http://www.cnrs.fr/), consultado em 06 de agosto, 2008 (Tradução - MIA). Nota do Scientific Editor: o artigo que deu origem a esta matéria, de título: "Identification of polyoxometalates as nanomolar noncompetitive inhibitors of protein kinase CK2", de autoria de R. Prudent, V. Moucadel, B. Laudet, C. Barette, L. Lafanechère, B. Hasenknopf, J. Li, S. Bareyt, E. Lacôte, S. Thorimbert, M. Malacria, P. Gouzerh and C. Cochet foi publicado na revista Chemistry and Biology, no final de julho, 2008. |
|||||||||||||||||||||||||